
近日,上海科技大学生命科学与技术学院刘冀珑课题组在学术期刊mLife上发表了题为“Filamentation and inhibition of prokaryotic CTP synthase with ligands”的研究成果,详细解析大肠杆菌胞苷三磷酸合成酶(CTP synthase,简称CTPS)的结构,并揭示其与多种配体的相互作用及其抑制机制。这项研究不仅为理解CTPS在生物体内的调控提供了新的视角,也为开发针对细菌病原体的新型治疗策略奠定了基础。

图:论文首页
CTPS在生物体内扮演着至关重要的角色,它负责催化胞苷三磷酸(Cytidine triphosphate, 简称CTP)的合成,而CTP是RNA和DNA合成的关键前体分子。CTPS能够直接识别并与所有四种核苷三磷酸(ATP、UTP、CTP和GTP)结合,并在体内形成细胞蛇(cytoophidia)和体外的代谢纤维,这些结构的形成和调控在不同尺度的层面上进行。
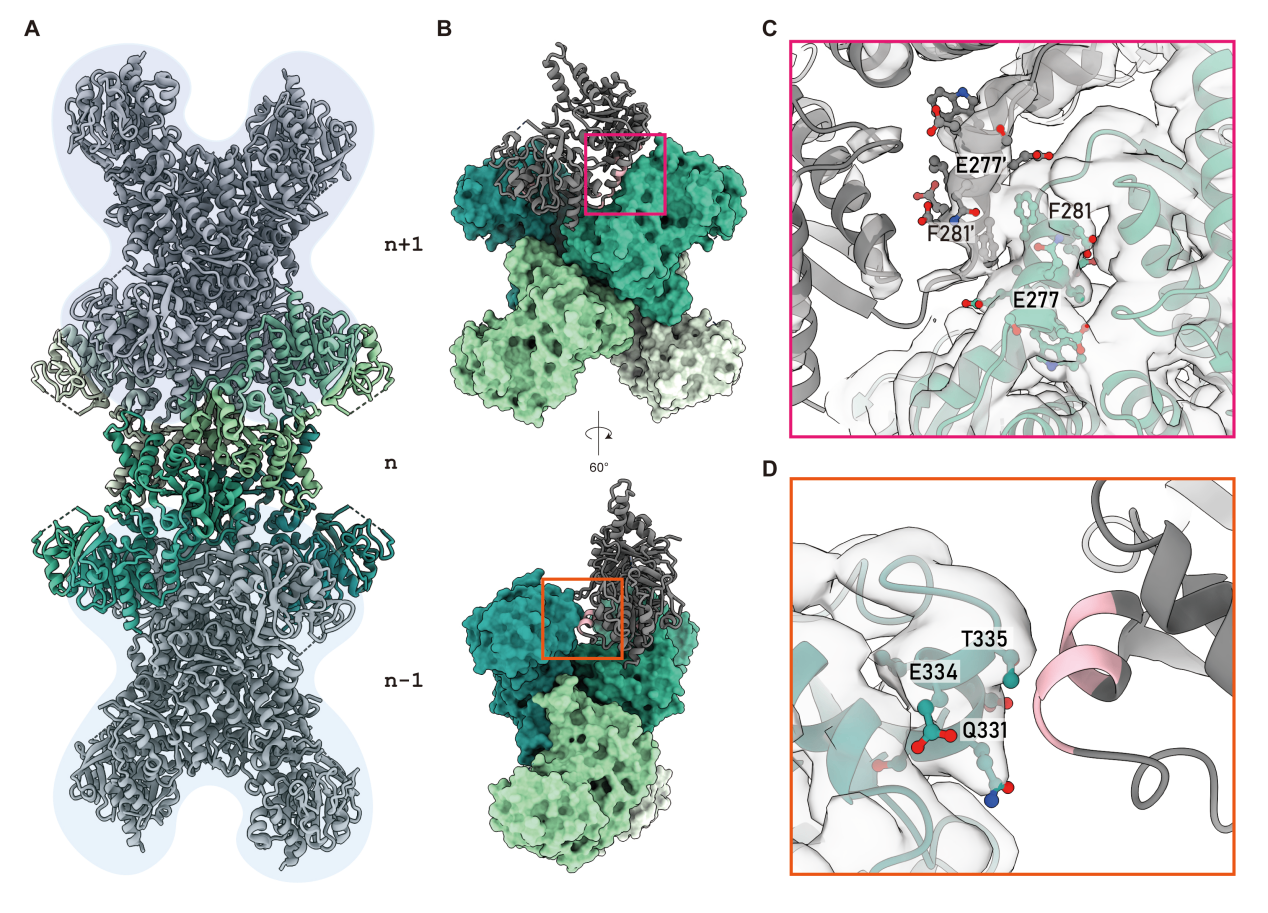
图:细菌胞苷三磷酸合酶代谢纤维的组装和结构。
研究团队利用冷冻电子显微镜解析了大肠杆菌CTPS(ecCTPS)与CTP、还原型烟酰胺腺嘌呤二核苷酸(Reduced Nicotinamide Adenine Dinucleotide,简称NADH)以及共价抑制剂6-Diazo-5-oxo-L-norleucine(DON)形成的复合物结构,分辨率达到了2.9埃。通过构建基于代谢纤维形成界面差异的系统发育树,研究人员发现了螺旋12对于CTPS代谢纤维形成的重要性,并设计了一种变体来验证他们的假设,揭示了螺旋12在CTPS代谢纤维化中的关键角色,为CTPS代谢纤维形成提供了进化视角。在DON结合后,ecCTPS内部形成了一个溶剂可及的氨气隧道,通过比较结构分析揭示了ecCTPS与真核生物CTPS在CTP结合方式上的显著差异。结合生化分析和结构分析,研究人员确定了CTP与NADH或腺嘌呤对ecCTPS的协同抑制效应。
这项研究丰富了对CTPS多样性调控机制的理解,为设计针对细菌CTPS的特异性抑制剂提供了科学基础。研究结果具有潜在的临床应用价值,有助于开发针对细菌感染和病毒感染的新药物。
上海科技大学生命学院2022级博士研究生郭陈君以及2020级本科生汪紫璇为该论文的共同第一作者,上科大生命学院教授、上海临床研究中心特聘科学家刘冀珑为该论文的通讯作者,上海科技大学为第一完成单位,上海临床研究中心为共同完成单位。
文章链接:https://onlinelibrary.wiley.com/doi/full/10.1002/mlf2.12119