
4月22日,上海科技大学生命科学与技术学院周智课题组与上海市第一人民医院男科李铮主任团队、中国科学院上海高等研究院王晨琛团队在衰老领域期刊《自然·衰老》(Nature Aging)上发表了题为“Targeting dysregulated phago-/auto- lysosomes in Sertoli cells to ameliorate late-onset hypogonadism”的研究论文,发现睾丸新陈代谢协调和衰老有密切联系,并且通过激动溶酶体功能的小分子可以减轻LOH小鼠的症状。
睾丸是精子发生和雄激素分泌的场所,睾丸衰老不仅导致生育力下降还严重影响男性生活质量。迟发性腺功能减退(Late onset Hypogonadism, LOH)是典型的睾丸衰老病变,以睾酮缺乏和其它相关临床症状为特征。长时间的睾酮缺乏还会引起糖尿病、高血脂等代谢综合征和阿尔茨海默病等疾病的发生,全因死亡率显著增加。 40岁以上男性发病率高达5.6-12.8%。随着世界范围的人口老龄化加剧,探索睾丸衰老的细胞和分子机制并开发有效的延缓和治疗手段,是应对人口老龄化的迫切需求。

周智课题组对正常和LOH患者睾丸组织进行了单细胞转录组测序。通过与团队前期完成的年轻人睾丸组织测序联合分析,研究人员发现LOH睾丸的体细胞微环境较生殖细胞出现更严重的衰老特征,其中以睾丸驻留的吞噬细胞——支持细胞的炎症分泌和老化表现最明显。此外,LOH病人支持细胞有显著的溶酶体和脂代谢相关基因失调,也出现了大量的溶酶体和脂质累积。
团队进一步探索支持细胞溶酶体缺陷和脂质累积的关系发现,支持细胞作为睾丸中营养和代谢的协调者,其溶酶体酸性降低会降低其代谢效率,导致其供给微环境的营养下降。
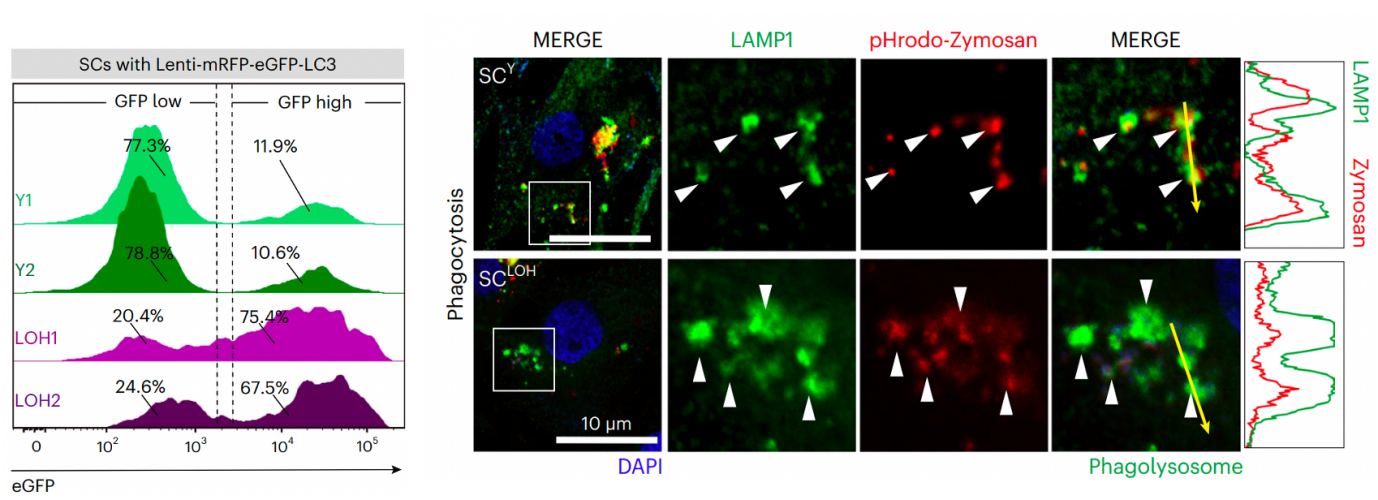
图1:左侧显示年轻人(Y)较性腺功能减退症病人(LOH)来源的支持细胞的自噬溶酶体酸性低;
右侧显示SCY较SCLOH的吞噬溶酶体(pHrodo-Zymosan)酸性低。
肥胖是LOH重要的风险因素,高脂饮食会显著抑制细胞溶酶体酸化。研究人员发现,细胞水平上,过量饱和脂肪酸(棕榈酸)显著增加了睾丸支持细胞的代谢压力,导致溶酶体酸性下降、代谢物累积。动物水平上,长期高脂喂养的小鼠也出现类似LOH病人的细胞学特征,并出现睾酮缺乏和性欲下降等症状。研究人员通过使用溶酶体TRPML激动剂ML-SA1,显著促进了受损支持细胞中吞噬/自噬溶酶体功能,改善了炎症分泌和代谢物累积等表型。由于支持细胞营养协调功能的恢复,ML-SA1也改善了长期高脂饲养小鼠的睾丸微环境和睾酮分泌。这说明提高支持细胞的代谢能力可以改善性腺功能退化的相关症状。

图2:示意图左侧显示Phago-/auto- dysregulated (PALD) SC中溶酶体酸度异常导致代谢物累积;
右侧通过改善溶酶体功能恢SC的代谢和营养支持功能。
综上所述,这项研究揭示了睾丸衰老的细胞和分子调控机制,为理解睾丸老化的代谢相互作用提供了重要的基础,也为临床评估LOH并制定长期干预措施提供了新靶点和新途径。
周智课题组2020级博士研究生邓植文、博士后李莎、课题组与上海交通大学医学院附属第一人民医院合作培养博士生赵亮宇为本文共同第一作者,周智为通讯作者。上海科技大学为第一完成单位,该研究也得到上海临床研究中心支持。
论文链接:https://www.nature.com/articles/s43587-024-00614-2