

2025年12月24日,苏州若弋生物科技有限公司注射用重组A型肉毒毒素(Sf9细胞,150kD天然氨基酸序列)获得国家药品监督管理局批准开展临床试验(受理号:CXSL2500908;药物临床试验批准通知书编号:2025LP03530),适应症为:成人上肢痉挛状态。
1. 关于肉毒毒素蛋白
肉毒毒素或肉毒素(Botulinum neurotoxin, BoNT),是肉毒梭状芽孢杆菌(Clostridium botulinum)产生的一类神经毒素蛋白。A型肉毒素(BoNT/A)蛋白全长150 kDa,在天然宿主细胞中会被切割为50 kDa的轻链(LC)和100 kDa的重链,通过二硫键相连(图1)。
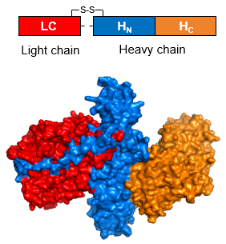
图1. A型肉毒素蛋白的结构。
重链的C端(HC)为受体结合结构域,可特定的结合神经细胞上高表达的神经节苷脂等分子;重链的N端(HN)为转运结构域,可将囊泡中的BoNT/A转运至细胞质中。轻链是Zn2+依赖的金属蛋白酶,特异性的切割SNARE复合物中的SNAP-25蛋白,从而阻断神经递质的释放,引起肌肉去神经化的萎缩,从而达到对神经-肌肉失调的治疗效果。
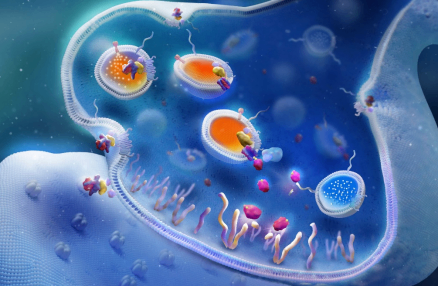
图2. A型肉毒素蛋白的作用机制。
2. 关于Sf9昆虫细胞
昆虫细胞的分离培养体系最早由美国农业部建立,并经孟山都公司进一步优化、通过杆状病毒的转染实现了高效的外源蛋白表达。由于杆状病毒质粒基因组(杆粒)具极大容量,因此易于表达复杂蛋白和蛋白复合物,在重组蛋白药物、疫苗、基因治疗载体(如AAV)等生物制剂的生产中具有极为广阔的应用前景;同时,由于昆虫细胞-杆状病毒体系无需构建稳转细胞株,因此省去了特异性细胞文库构建的时间,可用于季节性病毒(如流感)的重组蛋白疫苗的快速制备,如预防性疫苗。
然而,常规途径来源(一般供应商为赛默飞或ATCC)的Sf9细胞存在内源性病毒污染(弹状病毒),且现有杆粒体系存在目的蛋白的传代稳定性问题。上述两方面问题限制了昆虫细胞-杆状病毒体系的商业化应用。若弋生物通过技术攻关,建立了拥有自主产权的昆虫细胞-杆状病毒体系2.0,解决了弹状病毒污染和传代稳定性问题。此外,若弋生物还优化了Sf9体系的蛋白产量,并完成了无血清培养基的国产替代。
经若弋生物昆虫细胞平台制备的首个重组蛋白制剂(A型肉毒素)在临床I期试验中的耐受性表现良好,验证了此平台的巨大商业价值。
3. 关于适应症
本次批准的适应症为:成人上肢痉挛状态。上运动神经元损伤后常见的并发症,常见于脑卒中、脊髓损伤、脑外伤、多发性硬化等神经系统疾病患者。上肢痉挛状态的主要临床表现为肌肉不自主收缩、疼痛、运动受限、肢体僵硬和姿势异常等。
目前肉毒素药物对成人上肢痉挛状态的标准治疗方案遵循中国康复医学会发布的《肉毒毒素治疗成人肢体痉挛状态中国指南(2015)》。常见目标肌肉群为胸大肌、肱二头肌、旋前圆肌、尺侧腕屈肌、指深屈肌等。根据目标肌肉群不同,注射剂量从100 Units到600 Units不等。
4. 关于药物管线
本次批准临床试验为“注射用重组A型肉毒毒素(Sf9细胞,150kD天然氨基酸序列)”产品的第二项适应症;产品的首个适应症(暂时性改善65岁及65岁以下成人因皱眉肌和/或降眉间肌活动引起的中度至重度皱眉纹)目前已完成临床I期全部受试者出组,并已启动临床II期试验。
相比传统肉毒素产品或其他重组肉毒素产品,若弋生物的产品实现了四重革命:
(1)安全革命。通过采用昆虫细胞体系,规避了细菌体系的生物安全危害。
(2)工艺革命。通过若弋生物的工艺开发能力,规避了亲和层析标签和纯化的路径,从而实现产品的“全天然氨基酸序列”。
(3)毒性革命。拆分肉毒素生物药效和毒性,大幅降低药物弥散度、致肌肉塌陷特性及免疫原性。此结论被非临床试验非人灵长类数据和现有临床I期数据一致性的支持。
(4)药效革命。根据现有非临床和临床数据,本产品在起效时间、持续时间和安全窗口等方面存在潜在优势。